TOKIO - R-Tech Ueno (JASDAQ: 4573)
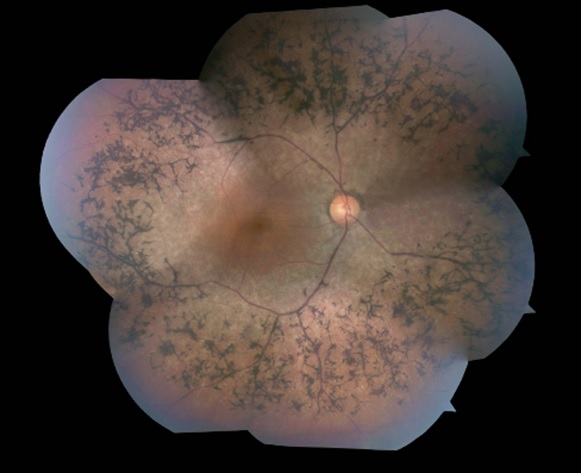
R-Tech Ueno, Ltd. ha anunciado hoy que ha recibido oficialmente la designación de fármaco huérfano por parte del Ministerio de Salud, Trabajo y Bienestar (MHLW) para la Unoprostona isopropílico (Unoprostona) (código de desarrollo: UF-021) para el tratamiento de la retinosis pigmentaria.
Medicamentos yArtículo productos biológicos con la designación de fármaco huérfano en Japón se definen como las destinadas a tratamientos seguros y efectivos, al diagnóstico y la prevención de las enfermedades raras / trastornos que afectan a menos de 50.000 pacientes (incidencia máxima de cuatro por diez mil), con incentivos para que los patrocinadores desarrollen productos huérfanos como revisión prioritaria de Aplicaciones de Nuevos Fármacos (NDA) por los farmacéuticos y Agencia de Dispositivos Médicos (PMDA), y conceder financiación para los patrocinadores.
Estamos desarrollando un agente terapéutico para el tratamiento de la retinosis pigmentaria con unoprostona como ingrediente principal y llevando a cabo un ensayo de fase 3 clínica de la solución oftálmica con unoprostona (código de desarrollo: UF-021) como el ingrediente principal (comunicado de prensa de 13 de marzo, 2013 ). Un ensayo clínico de fase 2 indica que el número de pacientes cuya sensibilidad en la retina central estaba deteriorada se redujo ( notas de prensa del 03 de junio y 15 de julio 2010 ). El desarrollo del tratamiento de la retinitis pigmentosa por unoprostona en Japón tiene el apoyo del gobierno y fue adoptado en el Adaptable y sin Trabas Tecnología Programa a través de (A-PASO) como I + D-Driven Target "a gran escala de I + D Etapa - Práctica Tipo Aplicación (Desarrollo Contrato)" por la Agencia Japonesa de Ciencia y Tecnología (JST) ( comunicado de prensa del 01 de febrero 2013 ). Estamos aumentando nuestros esfuerzos para la pronta aprobación de este fármaco.
Estamos autorizados del exterior para el desarrollo y los derechos de comercialización para unoprostona de Sucampo Pharmaceuticals, Inc. (Sucampo), para los Estados Unidos y Canadá en 2009, y luego a Estados Unidos, Canadá y el resto del mundo sin incluir nuestros propios territorios (Japón, Corea del Sur, Taiwán y China) en 2011. Si bien conservamos los derechos exclusivos para fabricar y suministrar productos unoprostona en nuestro territorio, que tienen una asociación eficaz con Sucampo para el desarrollo de ultramar de unoprostona.
Unoprostona ha sido designado como medicamento huérfano para el tratamiento de la retinosis pigmentaria, no sólo por la FDA en los Estados Unidos, sino también por la EMA en la Unión Europea, y socio de desarrollo del R-Tech Ueno, Sucampo decidirá en su camino hacia el futuro asumiendo nuestra Fase 3 de prueba si tiene éxito.
El emprendimiento anterior no contribuirá a toda revisión de las estimaciones de ganancias para todo el año pre-anunciados el 14 de mayo de 2014.
Para más detalles de la nota de prensa, por favor visite: http://www.rtechueno.com/en/investor/press/documents/141125_pr_en.pdf
Fuente: heraldonline.com
Información y comunicación de RETIMUR




 Los participantes que recibieron atención en el hogar por agentes de la rehabilitación visual se encontró que tenían una mejoría significativamente mayor en la función visual en comparación con los que sólo se les ofreció equipamiento de serie en los hospitales y servicios basados en la comunidad.
Los participantes que recibieron atención en el hogar por agentes de la rehabilitación visual se encontró que tenían una mejoría significativamente mayor en la función visual en comparación con los que sólo se les ofreció equipamiento de serie en los hospitales y servicios basados en la comunidad.
