Por: Tara Roberts | 19 de febrero de 2026
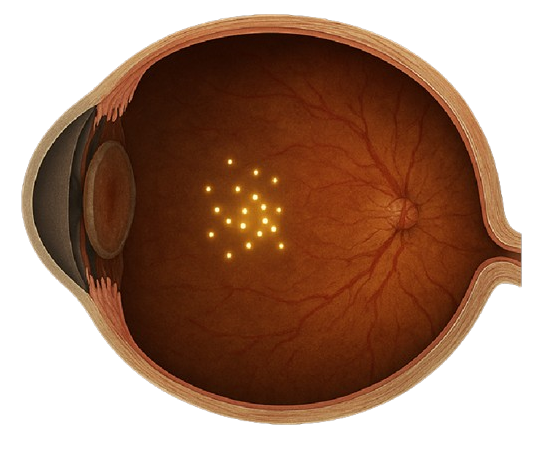
Macular telangiectasia tipo 2, o MacTel, es una enfermedad ocular rara que provoca una pérdida severa de la visión central. En diciembre de 2025, un hombre de Florida de 63 años se convirtió en la primera persona en el estado en recibir un nuevo implante que utiliza terapia génica para ralentizar los síntomas de la MacTel.
Thomas Albini, M.D., y su equipo en el Bascom Palmer Eye Institute, parte de la Miller School of Medicine de la Universidad de Miami, realizaron la cirugía para colocar el implante microscópico, llamado revakinagene taroretcel-lwey o Encelto. Es el primer tratamiento aprobado por la FDA diseñado específicamente para tratar la MacTel.
Este hito fue posible gracias a décadas de investigación para desarrollar tratamientos para enfermedades de la retina. Gran parte de este esfuerzo ocurrió en Bascom Palmer.